衛生福利部疾病管制署 2021 年 9 月 14
▍ BioNTech (BNT162b2) COVID-19 疫苗
BioNTech (BNT162b2) 之 COVID-19 疫苗是含有 SARS-CoV-2 病毒棘蛋白 (S protein) 之 mRNA 疫苗,用於預防 COVID-19,本疫苗已通過 WHO、歐盟等其他先進國家及我國緊急授權使用,適用於 12 歲以上,接種 2 劑。依據目前臨床試驗結果資料顯示本疫苗對於年滿 16 歲以上之青少年及成人受試者接 種完成 2 劑接種 7 天後預防有症狀感染之有效性約 94%,對於 12 至 15 歲青少年接種完成 2 劑接種 7 天 後預防有症狀感染之有效性約 100%* ,疫苗的保護效果需視接種對象的年齡或身體狀況而異;目前依衛生 福利部傳染病防治諮詢會預防接種組 (ACIP) 建議接種間隔為至少 4 週(28 天)。
▍BioNTech (BNT162b2) 疫苗接種禁忌與接種前注意事項
◆ BNT接種禁忌:對於疫苗成分有嚴重過敏反應史,或先前接種本項疫苗劑次發生嚴重過敏反應者,不予 接種。
◆ BNT注意事項:
1.本疫苗不得與其他廠牌交替使用。若不慎使用了兩劑不同 COVID-19 疫苗產品時,不建議再接種任 何一種產品。
2.目前尚無資料顯示與其他疫苗同時接種對免疫原性與安全性的影響。COVID-19 疫苗與其他疫苗的 接種間隔,建議間隔至少 7 天。如小於上述間隔,則各該疫苗亦無需再補種。
3.發燒或正患有急性中重度疾病者,宜待病情穩定後再接種。
4.免疫功能低下者,包括接受免疫抑制劑治療的人,對疫苗的免疫反應可能減弱。( 尚無免疫低下者 或正在接受免疫抑制治療者的數據 )
5.目前缺乏孕婦接種 COVID-19 疫苗之臨床試驗及安全性資料,而臨床觀察性研究顯示孕婦感染 SARS-CoV-2 可能較一般人容易併發重症。孕婦若為 COVID-19 之高職業暴露風險者或具慢性疾病 而易導致重症者,可與醫師討論接種疫苗之效益與風險後,評估是否接種。
6.若哺乳中的婦女為建議接種之風險對象 ( 如醫事人員 ),應完成接種。目前對哺乳中的婦女接種 COVID-19 疫苗的安全性、疫苗對母乳或受哺嬰兒之影響尚未完全得到評估,但一般認為並不會造 成相關風險。接種 COVID-19 疫苗後,仍可持續哺乳。
BioNTech (BNT162b2) COVID-19 疫苗接種須知
衛生福利部疾病管制署 2021 年 9 月 14 日 ▍接種後注意事項及可能發生之反應
1.為即時處理接種後發生率極低的立即型嚴重過敏反應,接種後應於接種單位或附近稍作休息留觀 15 分鐘,離開後請自我密切觀察 15 分鐘,但針對先前曾因接種疫苗或任何注射治療後發生急性過敏 反應之民眾,接種後仍請於接種單位或附近留觀至少 30 分鐘。使用抗血小板或抗凝血藥物或凝血 功能異常者施打後於注射部位加壓至少 2 分鐘,並觀察是否仍有出血或血腫情形。
2.疫苗接種後可能發生的反應大多為接種部位疼痛、紅腫,通常於數天內消失,其他可能反應包含疲 倦、頭痛、肌肉痠痛、畏寒、關節痛及發熱,通常輕微並於數天內消失。接種疫苗後可能有發燒反 應 (≥38℃ ),一般約 48 小時可緩解。
3.依據疫苗上市後資料,接種本項疫苗後曾出現極罕見的心肌炎和心包膜炎病例。這些病例主要發生 在接種後 14 天內,較常發生在接種第二劑之後以及年輕男性,但評估後本項疫苗用於年輕族群的 整體臨床效益仍大於其風險。若在接種疫苗後,出現疑似心肌炎或心包膜炎的症狀 ( 例如:急性和 持續性胸痛、呼吸急促或心悸 ),務必立即就醫。
4.如有持續發燒超過 48 小時、嚴重過敏反應如呼吸困難、氣喘、眩暈、心跳加速、全身紅疹等不適 症狀,應儘速就醫釐清病因,請您就醫時告知醫師相關症狀、症狀發生時間、疫苗接種時間,以做 為診斷參考。若為疑似疫苗接種後嚴重不良事件,可經由醫療院所或衛生局所協助通報至「疫苗不 良事件通報系統」(https://www.cdc.gov.tw/Category/Page/3-aXlTBq4ggn5Hg2dveHBg)。
5.完成疫苗接種後,雖可降低罹患 COVID-19 的機率,但仍有可能感染 SARS-CoV-2,民眾仍需注重 保健與各項防疫措施,以維護身體健康。
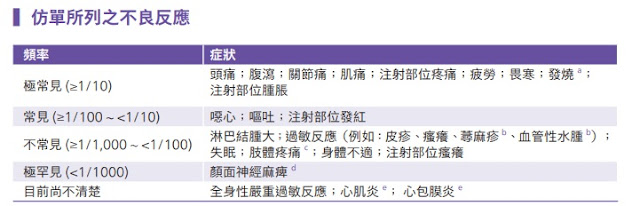
▍BioNTech (BNT162b2) 仿單所列之不良反應
a. 接種第二劑之後的發燒發生率較高。
b. 蕁麻疹和血管性水腫的發生率屬於罕見類別。
c. 指接種疫苗的手臂。
d. 在截至 2020 年 11 月 14 日的臨床試驗安全性追蹤期間,BNT162b2 疫苗組有 4 名受試者發生急性周邊面癱(或麻痺)。 症狀出現時間在第 1 劑接種後第 37 天(受試者未接種第 2 劑)以及第 2 劑接種後第 3、9 和 48 天。安慰劑組無急性周邊面 癱(或麻痺)病例。
e. 上市許可後確認的不良反應。另依據美國 FDA 上市後監測資料 (2021/8/23),心肌炎及心包膜炎相較於女性及年長男性常發 生於 40 歲以下男性,目前觀察風險較高為 12 至 17 歲青少年,經短期追蹤大多數個案經過治療後症狀已緩解。 參考資訊 * https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE_recommendation-BNT162b2-2021.1 如果您願意加入『V-Watch 疫苗接種 - 健康回報』,請您掃描接種院所提供之 QR code,並於疾管家提醒您時回覆健康情形,以應用於疫苗安全性評估。感謝您的協助! 衛生福利部疾病管制署 關心您
BioNTech COVID-19 疫苗接種評估及意願書

沒有留言:
張貼留言
手機選擇帳號後,按下發布 要再點選一次發布哦